Pengertian Ikatan Ion
Ikatan ion ini merupakan ikatan yang terbentuk yakni sebagai akibat adanya gaya tarikmenarik antara ion positif serta ion negatif. Ion positif ini terbentuk disebabkan karna unsur logam melepaskan elektronnya, sedangkan ion negatif itu terbentuk disebabkan karna unsur nonlogam menerima elektron. Ikatan ion ini terjadi disebabkan karna adanya serah terima elektron.
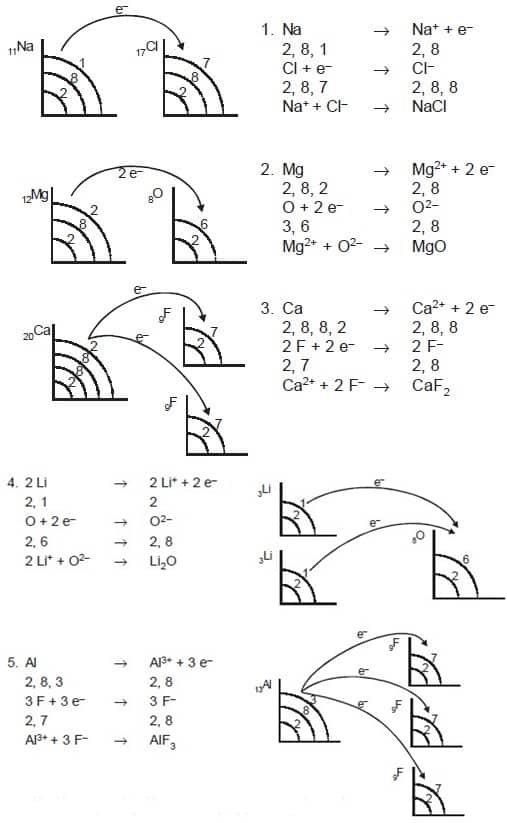
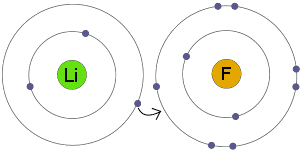
Ikatan ion ini terbentuk akibat dari adanya proses melepas atau juga menerima elektron oleh atom-atom yang saling berikatan. Atom-atom yang melepas elektron tersebut menjadi ion positif (kation) sedang untuk atom-atom yang menerima elektron tersebut menjadi ion negatif (anion). Ikatan ion tersebut biasanya disebut dengan ikatan elektrovalen. Senyawa yang mempunyai ikatan ion itu disebut senyawa ionik. Senyawa ionik tersebut biasanya terbentuk antara atom-atom unsur logam serta juga nonlogam. Atom unsur logam tersebut cenderung melepas elektron membentuk ion positif, serta atom unsur nonlogam itu cenderung menangkap elektron dan membentuk ion negatif. Contoh ialah seperti : MgO, CaF2, NaCl, Li2O, AlF3, serta lain-lain.
Syarat Terbentuknya Ikatan Atom
Atom-atom tersebut kemudian membentuk ikatan ion disebabkan karna tiap-tiap atom tersebut ingin mencapai keseimbangan/kestabilan ialah seperti pada struktur elektron gas mulia. Ikatan ion tersebut terbentuk antara sebagai berikut :
- Ion positif dengan ion negatif,
- Atom-atom tersebut berenergi potensial ionisasi kecil itu dengan atom-atom berafinitas elektron besar (Atom-atom unsur golongan IA, IIA tersebut dengan atom-atom unsur golongan VIA, VIIA),
- Atom-atom itu dengan keelektronegatifan kecil itu dengan atom-atom yang mempunyai keelektronegatifan besar.
Ikatan ion tersebut adalah suatu ikatan yang terjadi akibat suatu perpindahan elektron dari 1 atom itu ke atom lain (James E. Brady, 1990). Ikatan ion tersebut ituantara atom yang melepaskan electron (logam) tersebut dengan atom yang menangkap elektron (bukan logam). Atom logam, setelah kemudian melepaskan elektron tersebut berubah menjadi ion positif.
Sedangkan atom ini bukan logam, setelah menerima elektron kemudian berubah menjadi ion negatif. Antara ion-ion yang muatan nya itu berlawanan tersebutlah kmeudian terjadi suatu tarik-menarik (gaya elektrostastis) yang disebut dengan sebutan ikatan ion (ikatan elektrovalen). Senyawa yang mempunyai ikatan ion disebut senyawa ionik. Senyawa ionik ini biasanya terbentuk antara atom-atom unsur logam serta nonlogam.
Pembentukan Ikatan Ion
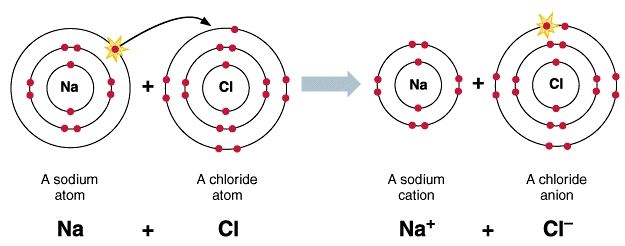
Proses terbentuknya ikatan ionik ini dicontohkan dengan pembentukan NaCl. Natirum (Na) itu dengan konfigurasi elektron (2,8,1) akan lebih stabil apabila melepaskan 1 elektron sehingga kemudian konfugurasi elektron itu berubah menjadi (2,8). Sedangkan untuk Klorin (Cl), yang memiliki dan/atau mempunyai suatu konfigurasi (2,8,7), akan lebih stabil apabila mendapatkan 1 elektron sehingga kemudian konfigurasinya tersebut menjadi (2,8,8). Jadi supaya keduanya ini kemudian menjadi lebih stabil, maka natrium tersebut menyumbang 1 elektron serta klorin tersebut kemudian akan kedapatan satu elektron dari natrium.
Pada saat natrium kehilangan satu elektron, maka natrium ini menjadi lebih kecil. Sedangkan klorin tersebut akan menjadi lebih besar disebabkan karna ketambahan satu elektron. Oleh karna itu ukuran ion positif tersebut selalu lebih kecil daripada ukuran sebelumnya, namun tetapi untuk ion negatif tersebut akan lebih condong lebih besar daripada ukuran sebelumnya. Disaat pertukaran elektron terjadi, maka Na ini akan menjadi bermuatan positif (Na+) serta Cl itu akan menjadi bermuatan negatif (Cl–). Setelah itu terjadi gaya elektrostatik antara Na+ serta Cl– sehingga membentuk ikatan ionik.
Sebagimana ini disebutkan di atas bahwa ikatan ion ialah ikatan yang terjadi akibat perpindahan elektron dari satu atom ke atom lain. Perlu untuk diingat, ikatan antar unsur tersebut akan stabil apabila eletron terluar tersebut berjumlah 2 serta 8. maka Lihat pada contoh pembentukan ikatan ion antara unsur Na (natrium) serta juga Cl (klorida) berikut ini:
Ikatan ion ialah ikatan yang relatif kuat. Disuhu kamar, seluruh senyawa ion tersebut berupa zat padat kristal dan dengan struktur tertentu. Dengan memakai lambang Lewis, pembentukan NaCl tersebut digambarkan sebagai berikut ini.
Lambang titik elektron Lewis initerdiri atas lambang unsur serta juga titik-titik yang ditiap titiknya itu menggambarkan 1 elektron valensi dari atom unsur. Titik-titik elektron tersebut merupakan elektron terluarnya.
Sifat Ikatan Ion
Selain sifatnya itu yang relatif kuat, ikatan ion ini juga mempunyai beberapa sifat yang lain, diantaranya ialah sebagai berikut:
- Memiliki titik didih serta titik leleh yang tinggi. Ion positif dan juga ion negatif di dalam kristal senyawa ion tidak bebas tersebut bergerak disebabkan oleh karna terikat oleh gaya elektrostatik yang kuat. Diperlukan suhu yang tinggi supaya ion-ion tersebut memperoleh energi kinetik yang cukup untuk mengatasi gaya elektrostatik.
- Keras tetapi rapuh. Memiliki sifat keras disebabkan karna karena ion-ion positif serta negatif terikat kuat ke segala arah oleh gaya elektrostatik. Mempunyai sifat rapuh disebabkan oleh karna lapisan-lapisan tersebut bisa atau dapat bergeser apabila dikenakan gaya luar, ion sejenis tersebut bisa atau dapat berada satu di atas yang lainnya sehingga kemudian timbul/muncul tolak-menolak yang sangat kuat yang setelah itu menyebabkan terjadinya pemisahan.
- Berupa padatan pada suhu ruang.
- Larut di dalam pelarut air, tetapi dasarnya tidak larut dalam pelarut organik
- Tidak menghantarkan listrik di dalam fasa padat, namun menghantarkan listrik di dalam fasa cair. Zat dikatakan dapat atau bisa menghantarkan listrik apabila terdapat ion-ion yang bisa atau dapat bergerak bebas membawa muatan listrik.
Ciri Ikatan Ion
Keberadaan ikatan ion juga mempengaruhi dari sifat kimia serta fisik dari senyawa yang dihasilkan. Terdapat beberapa karakteristik tersebut menonjol dari ikatan ion dan juga dibawah ini merupakan daftar dari beberapa dari karakteristik ikatan ion berikut:
Disebabkan kenyataan bahwa logam ini cenderung kehilangan elektron serta juga non-logam tersebut cenderung untuk mendapatkan elektron, ikatan ion yang umum antara logam serta juga non-logam. Oleh sebab itu, tidak seperti ikatan kovalen yang hanya bisa atau dapat terbentuk antara non-logam, ikatan ion tersebut dapat atau bisa terbentuk antara logam serta non-logam.
Sementara penamaan senyawa ion, nama logam ini selalu datang pertama serta nama non-logam datang kedua. Misalnya, di dalam kasus natrium klorida (NaCl), natrium ialah logam sedangkan klorin itu ialah non-logam.
Senyawa yang mengandung ikatan ion mudah larut di dalam suatu air serta juga beberapa pelarut polar lainnya. Ikatan ion, itu dengan demikian, memiliki efek pada kelarutan senyawa yang dihasilkan.
Disaat senyawa ion tersebut dilarutkan di dalam pelarut untuk kemudian membentuk larutan homogen, larutan tersebut cenderung untuk menghantarkan listrik.
Ikatan ion ini memiliki efek pada titik leleh senyawa juga, disebabkan karna senyawa ion ini cenderung memiliki titik leleh yang lebih tinggi, yang berarti bahwa ikatan ion itu tetap stabil untuk rentang suhu yang lebih besar.
Ikatan ion itu terjadi disebabkan karna adanya gaya tarik-menarik antar ion yang bermuatan positif serta ion yang bermuatan negative.
Dinyatakan oleh Wibowo (2013) terdapat beberapa yang kemudian perlu diperhatikan, biasanya itu terjadi kesalahan konsep di dalam materi ikatan kimia ini, ialah seperti contoh sebagai berikut :
- Ikatan ionik ini hanya dapat atau bisa terjadi antara kation serta anion sederhana,
- Senyawa ionik ini hanya dapat atau bisa terbentuk dengan secara langsung dari ion-ion, dll
Pada formula atau juga rumus ionik. Senyawa ion tersebut tidak ada sebagai molekul, sehingga kemudian kita tidak dapat atau bisa mengetahui mengenai rumus molekul dari senyawa ion. Sebagai gantinya, rumus ionik dalam suatu senyawa ialah rumus empiris senyawa itu. Seperti contoh, natrium klorida rumusnya ialah NaCl.
Dinyatakan oleh Saunders (2007) bahwa terdapat beberapa jumlah yang juga sama dengan ion didalam kisi ioniknya, seperti contoh :
- Magnesium Oksida ini berisi Mg2+ dan O2- ion, serta rumusnya ialah MgO
- Kalsium Klorida ini berisi Ca2+ dan cl2- ion, serta rumusnya ialah CaCl2
- Alumunium Oksida ini berisi Al3+ dan O2- ion, serta rumusnya ialah Al2O3
Contoh Pembentukan Ikatan ion NaCl
Bila sebuah atom Na itu mendekati Cl, maka Na kemudian akan menyerap energi ionisasi tertentu sehingga kemudian mampu untuk melepaskan sebuah elektron serta berubah menjadi ion Na⁺
₁₁Na = 2 . 8 . 1 > kemudian akan menyerap energi serta membentuk ion Na⁺
₁₇Cl = 2 . 8. 7 > kemudian akan melepas energi serta membentuk ion Cl⁻.
Elektron yang dibebaskan oleh atom Na tersebut kemudian akan diterima oleh atom Cl, sehingga atom Cl itu akan berubah menjadi ion Cl⁻. Proses pengikatan elektron ini kemudian membebaskan energi tertentu sebesar afinitas elektronnya.
Antara ion-ion Na⁺ serta Cl⁻ tersebut terjadi gaya tarik-menarik elektrostatis, sehingga kemudian terbentuklah senyawa ion NaCl.
Demikianlah penjelasan mengenai Pengertian Ikatan Ion, Syarat, Ciri, Sifat, Pembentukan dan Contoh, semoga yang diuraikan dapat bermanfaat untuk anda. Terima kasih