Pengertian Sel Elektrolisis
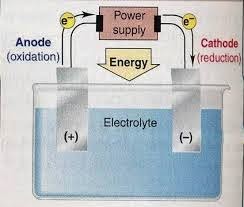
Sel elektrolisis ini merupakan sel elektrokimia yang mana energi listrik tersebut digunakan untuk menjalankan reaksi redoks itu tidak spontan. Reaksi elektrolisis tersebut bisa atau dapat didefinisikan yakni sebagai reaksi peruraian zat yakni dengan menggunakan arus listrik. Prinsip kerja dari sebuah sel elektrolisis ini ialah untuk menghubungkan kutub negatif dari sumber arus itu searah dengan katode serta juga kutub positif itu ke anode sehingga hal tersebut terjadi suatu overpotensial yang menyebabkan suatu reaksi reduksi serta oksidasi itu tidak spontan dapat atau bisa berlangsung. Elektron tersebut akan mengalir dari katode ke anode. Ion-ion positif tersebut akan cenderung tertarik ke katode dan juga tereduksi, sedangkan untuk ion-ion negatif itu akan cenderung tertarik ke anode serta teroksidasi.
Susunan Sel Elektrolisis
Secara umum, sel elektrolisis ini tersusun dari:
- Sumber listrik yang menyuplai arus searah (dc), misalnya baterai.
- Anode, yaitu elektrode tempat terjadinya reaksi oksidasi.
- Katode, yaitu elektrode tempat terjadinya reaksi reduksi.
- Elektrolit, yaitu zat yang dapat menghantarkan listrik.
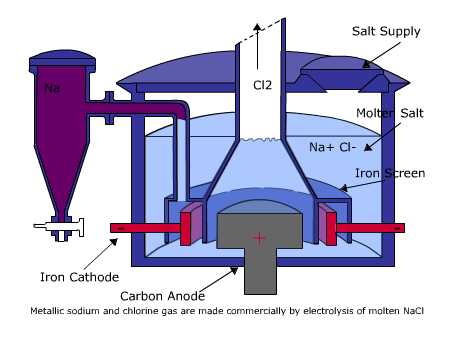
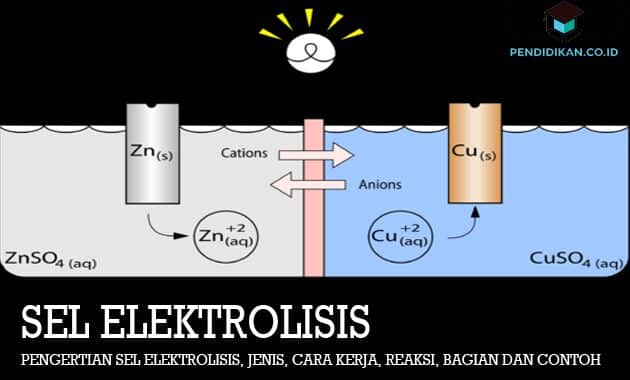
Pada gambar yang ada di atas, terlihat rangkaian suatu sel elektrolisis lelehan NaCl. Sel elektrolisis tersebut tidak memerlukan jembatan garam yakni seperti halnya sel Volta. Elektrode yang digunakan tersebut bisa atau dapat berupa elektrode inert seperti misalnya platina atau grafit yang tidak teroksidasi ataupun juga tereduksi dalam sel.
Proses elektrolisis ini dimulai dengan dialirkan suatu arus listrik itu searah dari sumber tegangan listrik. Elektron dari kutub negatif tersebut akan mengalir menuju ke katode. Akibatnya adalah, ion-ion positif Na+ di dalam lelehan NaCl tersebut akan tertarik ke katode serta kemudian menyerap elektron untuk tereduksi menjadi Na yang netral. Sementara itu untuk, ion-ion negatif Cl− di dalam lelehan tersebut akan tertarik ke anode pada kutub positif. Ion-ion Cl− tersebut akan teroksidasi menjadi gas Cl2 yang netral yakni dengan melepas elektron. Elektron itu kemudian akan dialirkan anode serta diteruskan ke kutub positif sumber tegangan listrik. Jadi, reaksi redoks yang terjadi pada sel elektrolisis lelehan NaCl tersebut bisa atau dapat ditulis sebagai berikut.
- Katode (reduksi) = Na+(l) + e− → Na(l)
- Anode (oksidasi) = 2Cl−(l) → Cl2(g) + 2e−
- Reaksi sel(redoks) = 2Na+(l) + 2Cl−(l) → 2Na(l) + Cl2(g)
Bagian Sel Elektrolisis
Di dalam sel elektrolisis itu terdapat beberapa bagian dari suatu rangkaian yang tentunya harus dipenuhi untuk terjadinya peristiwa atau kejadian dari elektrokimia ini. Bagian bagian utama dari sel elektrolisis tersebut diantaranya sebagai berikut;
Elektroda
Elektroda ini adalah suatu penghantar yang dapat atau bisa menghantarkan arus listrik yang mana pada sel elektrolisis, elektroda tersebut dibagi menjadi dua jenis diantaranya anoda serta katoda.
Di dalam proses elektrolisis, tiap-tiap anoda tersebut mempunyai fungsi tersendiri yakni seperti anoda yang memiliki fungsi sebagai tempat terjadinya reaksi oksidasi serta juga katoda yang memiliki fungsi sebagai tempat terjadinya reaksi reduksi. Kedua dari reaksi tersebut saling melengkapi antara satu sama lain serta selalu terjadi dengan secara bersamaan.
Pemilihan elektroda tersebut bisa atau dapat dilihat dari nilai potensial reduksi yang disesuaikan yakni dengan zat yang akan direaksikan. Pada dasarnya, elektroda yang dipilih itu memiliki sifat inert atau tidak bereaksi terhadap larutan atau juga reagen yang digunakan serta juga elektroda ini memiliki sifat aktif yang dapat atau bisa bereaksi dengan larutan.
Contoh dari elektroda inert yang sering digunakan diantaranya platina serta karbon, sedangkan untuk elektroda aktif yang sering digunakan diantaranya tembaga serta nikel.
Elektrolit
Elektrolit ini adalah suatu larutan yang mampu untuyk menghantarkan listrik atau juga mempunyai suatu daya hantar listrik yang tinggi. Pada dasarnya, larutan elektrolit tersebut mempunyai ion ion terlarut dengan konsentrasi yang cukup tinggi sehingga dari hal tersebut pergerakan ion di dalam larutan itu memiliki peran di dalam sifat konduktivitasnya.
Ion yang berada di dalam larutan elektrolit itu nantinya akan bereaksi serta mengalami reaksi baik itu reduksi atau jgua oksidasi yang terjadi di dalam elektroda yakni dengan adanya arus listrik yang dilewatkan. Contoh dari larutan elektrolit ialah CuSO4 serta NaCl.
Sumber Arus Listrik
Sumber arus listrik ini juga sangat penting guna terjadinya reaksi reduksi serta oksidasi. Arus listrik dapat berupa listrik searah (DC) itu akan dialirkan dengan melalui kedua elektroda itu dengan berlawanan muatan ke dalam larutan elektrolit.
Adanya arus listrik ini tentu akan menyebabkan terjadinya pergerakan elektron dari anoda ke katoda yang menyebabkan reaksi pada anoda itu terjadi secara oksidasi serta pada katoda itu terjadi reduksi. Tanpa adanya arus listrik, reaksi reduksi serta oksidasi ini tidak akan berlangsung disebabkan karna tidak terjadi transfer elektron di dalam sistem tersebut.
Jenis Sel Elektrolisis
Sel elektrolisis ini dapat diklasifikasikan dengan berdasarkan jenis larutan elektrolit atau juga dengan berdasarkan elektroda yang digunakan. dibawah ini merupakan jenis jenis sel elektrolisis;
Sel Elektrolisis Lelehan/Leburan
Sel elektrolisis ini adalah suatu sistem elektrolisis itu dengan elektrolit berupa hasil lelehan atau leburan pada suatu zat itu tanpa adanya pelarut air.
Di dalam jenis elektrolit ini hanya ada kation serta anion tanpa adanya suaut molekul H2O. Di dalam jenis elektrolisis tersebut juga, kation itu akan direduksi di dalam katoda sedangkan untuk anion itu akan dioksidasi di dalam anoda dengan secara langsung. Contoh dari jenis elektrolisis ini ialah dengan menggunakan lelehan NaCl.
Sel Elektrolisis Larutan
Untuk jenis ini adalah lawan dari jenis sebelumnya yang mana elektrolit yang digunakan itu berupa larutan dengan pelarut air. Hal tersebut artinya di dalam elektrolit terdapat sebuah anion, kation, serta juga molekul H2O sehingga oleh karna keberadaan air itu juga akan diperhitungkan terjadi persaingan pada saat reaksi berlangsung.
Elektrolisis larutan ini juga terbagi menjadi dua jenis diantaranyaelektrolisis larutan dengan elektroda inert serta elektroda aktif. Contoh dari sel elektrolisis ini ialah dengan menggunakan elektrolit larutan CuSO4.
Cara Kerja Sel Elektrolisis
Di dalam sel elektrolisis yang telah atau sudah dirangkai dengan 3 komponen utama yang lengkap maka sel itu kemudian sudah dapat atau bisadijalankan sebagaimana mestinya. Prinsip kerja dari sel elektrolisis ini adalah pada saat arus listrik tersebut dialirkan di dalam elektroda, pada anoda itu akan diberi muatan positif dan sedangkan untuk katoda itu akan diberi muatan negatif.
Maka akan terjadi sebuah pergerakan elektron akibat dari adanya arus listrik tersebut, elektron tersebut bergerak dari anoda itu menuju katoda. Akibatnya, adalah di dalam anoda tersebut akan terjadi kekurangan elektron sehingga anoda itu kemudian akan menarik elektron dari larutan elektrolit yang mempunyai kandungan anion yang memiliki muatan negatif serta juga akan mengalami reaksi oksidasi itu dengan kehilangan elektron.
Pada katoda ini mempunyai banyak muatan negatif sehingga dari hal tersebut membutuhkan muatan positif untuk dapat menetralkannya, oleh sebab itu katoda ini cenderung menarik kation di dalam elektrolit sehingga kation itu kemudian akan direduksi yakni dengan menerima elektron.
Reaksi Elektrolisis
Secara umum untuk, elektrolisis lelehan senyawa ionik tersebut melibatkan reaksi redoks yang lebih sederhana. Hal tersebut disebabkan karna tanpa adanya air, kation tersebut akan direduksi di katode serta anion itu akan dioksidasi di anoda. Sebagai contoh ialah, pada elektrolisis lelehan MgBr2, ion Mg2+ tersebut akan tereduksi di katode membentuk logam Mg dan juga ion Br− akan teroksidasi pada anode membentuk gas Br2.
Tetapi, apabila reaksi elektrolisis tersebut berlangsung di dalam sistem larutan, terdapat beberapa reaksi redoks yang bersaing sehingga dari hal tersebut reaksi cenderung agak kompleks. Beberapa faktor yang menentukan dari reaksi elektrolisis larutan elektrolit ini antara lain sebagai berikut.
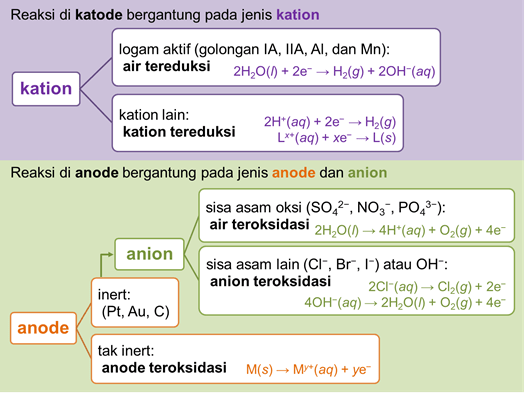
1. Sesi-spesi yang berada di dalam larutan elektrolit
spesi yang tereduksi ini merupakan spesi dengan potensial reduksi yang lebih positif
spesi yang teroksidasi ini merupakan spesi dengan potensial reduksi yang lebih negatif (potensial oksidasi lebih positif)
2. Sifat bahan elektrode, inert atau aktif
elektrode inert ini merupakan elektrode yang tidak terlibat di dalam reaksi redoks elektrolisis. Contoh ialah seperti: platina (Pt), emas (Au), dan grafit (C)
elektrode aktif ini merupakan suatu elektrode yang dapat atau bisa terlibat di dalam reaksi redoks elektrolisis. Contoh ialah seperit: tembaga (Cu), krom (Cr), serta nikel (Ni)
3. Potensial tambahan (overpotensial) yang diberikan
Overpotensial tersebut dibutuhkan untuk dapat melampaui interaksi pada permukaan elektrode yang umumnya itu sering terjadi pada saat elektrolisis menghasilkan gas.
Dengan berdasarkan data potensial elektrode standar, reaksi elektrolisis larutan elektrolit pada keadaan standar bisa atau dapat diprediksikan dengan mengikuti ketentuan berikut.
Sebagai contoh, bisa diperhatikan perbedaan elektrolisis larutan AgNO3 itu dengan elektrode grafit serta juga elektrode perak (Ag) berikut.
a. Elektrolisis larutan AgNO3 dengan elektrode grafit
Pada katode, spesi yang mengalami reduksi ini ialah Ag+. Hal tersebut disebabkan karna Ag ini tidak termasuk logam aktif yang potensial reduksinya itu lebih negatif dari potensial reduksi air.
Katode: Ag+(aq) + e− → Ag(s)
Pada anode, elektrode grafit tersebut termasuk elektrode inert sehingga dari hal tersebut tidak teroksidasi. Spesi NO3− ini adalah sisa asam oksi yang sukar teroksidasi, akibatnya ialah air yang akan teroksidasi.
Anode: 2H2O(l) → 4H+(aq) + O2(g) + 4e−
b. Elektrolisis larutan AgNO3 dengan elektrode perak
Pada katode, spesi yang mengalami reduksi itu ialah Ag+. Spesi yang tereduksi pada katode ini tidak bergantung pada elektrode yang digunakan, tetapi hanya bergantung pada jenis dari kation larutan elektrolit.
Katode: Ag+(aq) + e− → Ag(s)
Pada anode, elektrode Ag tersebut tidak termasuk elektrode inert sehingga hal tersebut akan teroksidasi.
Anode: Ag(s) → Ag+(aq) + e−
Contoh Soal Sel Elektrolisis serta Pembahasan
Tuliskanlah reaksi elektrolisis dibawah ini.
a. elektrolisis larutan CuSO4 dengan elektrode tembaga
b. elektrolisis larutan KI dengan elektrode grafit
c. elektrolisis lelehan CaCl2 dengan elektrode platina
Jawab:
- CuSO4(aq) → Cu2+(aq) + SO42−(aq)
Cu ini tidak termasuk logam aktif, sehingga dari hal tersebut kation Cu2+ tersebut akan tereduksi pada katode. Oleh sebab itu elektrode tembaga (Cu) ini tidak termasuk elektrode inert, maka anode Cu tersebut akan teroksidasi.
Katode : Cu2+(aq) + 2e− → Cu(s)
Anode : Cu(s) → Cu2+(aq) + 2e−
Reaksi sel : Cu(s)anode → Cu(s)katode
- KI(aq) → K+(aq) + I−(aq)
K ini termasuk logam aktif, sehingga dari hal tersebut air akan tereduksi di katode. Oleh sebab itu elektrode grafit ini termasuk elektrode inert serta anion I− itu tidak termasuk sisa asam oksi, maka oleh karna itu anion I− itu akan teroksidasi pada anode.
Katode : 2H2O(l)+2e− → H2(g)+2OH−(aq)
Anode : 2I−(aq) → I2(g)+2e−
Reaksi sel : 2H2O(l) +2I−(aq) →H2(g)+2OH−(aq)+I2(g)
- CaCl2(l) → Ca2+(l) + 2Cl−(l)
Untuk elektrolisis lelehan senyawa ionik CaCl2 tersebut dengan elektrode platina (ini termasuk elektrode inert), kation Ca2+ tersebut akan tereduksi pada katode serta anion Cl− maka akan teroksidasi di anode.
Katode : Ca2+(l) + 2e− → Ca(s)
Anode : 2Cl−(l) → Cl2(g) + 2e−
Reaksi sel : Ca2+(l) + 2Cl−(l) → Ca(s) + Cl2(g)
Demikianlah penjelasan mengenai Pengertian Sel Elektrolisis, Jenis, Cara Kerja, Reaksi, Bagian dan Contoh, semoga apa yang diuraikan dapat bermanfaat untuk anda.Terima kasih