Pendidikan.Co.Id – Afinitas elektron merupakan ukuran dari enegi yang dilepaskan atau juga diserap oleh atom netral dalam bentuk gas jika aterjadi penangkapan satu elektron yang ditempatkan pada kulit terluarnya serta juga atom menjadi ion negatif. Afinitas elektron tersebut dapat berharga positif dan juga negatif. Afinitas elektron berharga negatif jika dalam proses penangkapan satu elektron, energi dilepaskan. Ion negatif yang terbentuk akibat dari proses tersebut bersifat stabil. Hal sebaliknya akan terjadi jika dalam sebuah proses penangkapan satu elektron, energi diserap. Penyerapan energi terseebut menyebabkan ion yang terbentuk bersifat tidak stabil. Jadi Semakin negatif harga afinitas lektron pada suatu atom unsur maka ion yang terbentuk juga semakin stabil. untuk lebih jelasnya dibawah ini :
Pengertian Afinitas Elektron
Afinitas elektron ini didefinisikan ialah sebagai perubahan energi (kJ / mol) dari atom netral (dalam fase gas) pada saat sebuah elektron ditambahkan ke atom untuk membentuk ion negatif. Artinya kata lain, kemungkinan atom netral itu yang memperoleh atau mendapatkan elektron. Afinitas elektron itu merupakan salah satu sifat keperiodikan unsur. Disebabkan karena energi dilepas, maka harga afinitas elektron tersebut diberi tanda minus.
Sifat Afinitas Elektron dalam Sistem Keperiodikan Unsur
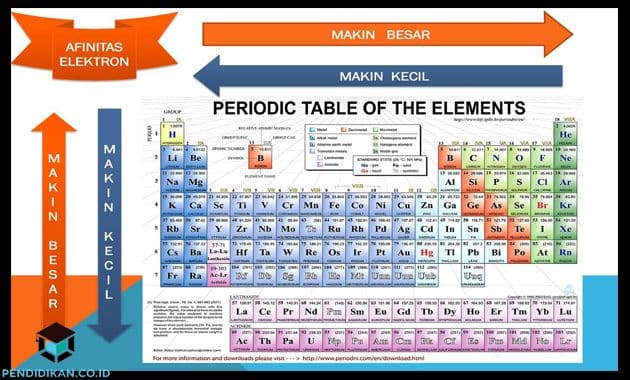
- Dalam satu golongan, afinitas elektron ini cenderung berkurang dari atas ke bawah
- Dalam satu periode, afinitas elektron ini cenderung bertambah dari kiri ke kanan.
- Kecuali unsur alkali tanah serta jugagas mulia, semua unsur golongan utama memiliki afinitas elektron bertanda negatif. Afinitas elektron terbesar dimiliki oleh golongan halogen.
Pada saat sebuah elektron ituditambahkan ke atom netral, yaakni afinitas elektron pertama, energi dilepaskan; dengan demikian, afinitas elektron pertama yang negatif. Tetapi, pada saat sebuah elektron itu ditambahkan pada ion negatif, yakni kedua afinitas elektron, lebih banyak energi yang diperlukan. Dengan demikian, lebih banyak energi yang dilepaskan untuk bisa menambahkan elektron ke ion disebabkan ion negatif harus memaksa elektron untuk dapat masuk ke elektron orbital; dengan demikian, afinitas elektron kedua yang positif.
Afinitas Elektron Pertama :
- X (g) + e- → X- (g) (1)
Afinitas Elektron Kedua :
- X- (g) + e- → X2- (g) (2)
Energi ionisasi itu selalu berhubungan dengan pembentukan ion positif. Afinitas elektron itu ialah setara ion negatif, dan penggunaannya hampir juga selalu terbatas pada unsur-unsur dalam kelompok 16 serta 17 dari tabel periodik. Pertama afinitas elektron merupakan energi yang dilepaskan pada saat 1 mol atom gas masing-masing memperoleh elektron untuk membentuk 1 mol ion gas -1. Hal tersebut adalah energi yang dilepaskan (per mol X) pada saat perubahan ini terjadi. Afinitas elektron pertama mempunyai nilai negatif. Sebagai contoh, afinitas elektron pertama klor ialah -349 kJ /mol. Dengan konvensi, tanda negatif itu menunjukkan pelepasan energi.
Jenis Afinitas Elektron
Afinitas elektron ini dibedakan menjadi afinitas elektron logam dan non logam, penjelasnnyaa sebagai berikut :
Afinitas Elektron Logam
Pada saat sebuah elektron itu ditambahkan elemen logam, energi yang dibutuhkan untuk bisa mendapatkan bahwa elektron (reaksi endoterm). Logam tersebut memiliki kesempatan lebih kecil kemungkinannya untuk bisaa mendapatkan elektron disebabkan karena lebih mudah untuk kehilangan elektron kelambu dan jugga bentuk kation. Lebih mudah untuk kehilangan elektron valensi mereka disebabkan inti logam ‘tidak memiliki tarikan yang kuat pada elektron valensi mereka. Oleh demikian, logam itu diketahui mempunyai afinitas elektron yang lebih rendah. Kecenderungan afinitas elektron yang lebih rendah untuk logam itu digambarkan sebagai berikut.
Lithium (Li) : 60 KJ /mol
Natrium (Na) : 53 KJ /mol
Kalium (K) : 48 KJ/ mol
Rubidium (Rb) : 47 KJ /mol
Cesium (Cs) : 46 KJ /mol
Perhatikan bahwa afinitas elektron itu menurun ke bawah dalam satu (1) golongan
Afinitas Elektron non logam
Pada saat non logams itu mendapatkan elektron, perubahan energi tersebut biasanya negatif karena mereka mengeluarkan energi untuk membentuk anion (proses eksotermis); oleh demikian, afinitas elektron itu akan menjadi angka negatif.
Non logam ini mempunyai afinitas elektron lebih besar dari logam karena struktur atom mereka:
- pertama, non logams mempunyai lebih elektron valensi dari logam lakukan, sehingga akan lebih mudah untuk non logams untuk bisa mendapatkan elektron untuk memenuhi oktet yang stabil dan
- kedua, kulit valensi elektron itu lebih dekat dengan inti, sehingga akan lebih sulit untuk menghapus sebuah elektron dan lebih mudah untuk bisa menarik elektron dari unsur lain (terutama logam).
Dengan demikian, non logams ini memiliki afinitas elektron tinggi dari logam, yang artinya ialah mereka lebih mungkin untuk mendapatkan elektron dari atom dengan afinitas elektron yang lebih rendah.
Sebagai contoh, nonlogam seperti elemen dalam seri halogen di Golongan 17 mempunyai afinitas elektron lebih tinggi dari logam. Tren ini dijelaskan sebagai berikut. Lihatlah tanda negatif (-) untuk afinitas elektron yang memperlihatkan atau menunjukan bahwa energi yang dilepaskan.
Fluor (F) : -328 kJ/ mol
Klorin (Cl) : -349 kJ/ mol
Brom (Br) : -324 kJ /mol
Yodium (I) : -295 kJ /mol
Perhatikan bahwa afinitas elektron tersebut menurun ke bawah kelompok, namun meningkatkan dengan periode.
Pola Afinitas Elektron
Afinitas elektron ini meningkat ke atas untuk kelompok dan juga dari kiri ke kanan di periode tabel periodik disebabkana karena elektron ditambahkan ke tingkat energi menjadi lebih dekat dengan inti, sehingga akan menjadi daya tarik kuat antara inti serta elektron. Ingat bahwa lebih besar jarak, kurang dari daya tarik; oleh demikian, lebih sedikit energi yang dilepaskan pada saat sebuah elektron itu ditambahkan ke luar orbit. Selain dari itu, elektron valensi juga lebih elemen mempunyai , semakin besar kemungkinan itu ialah untuk mendapatkan elektron untuk membentuk oktet yang stabil. Semakin sedikit elektron valensi atom dimiliki, maka paling besar kemungkinan akan mendapatkan elektron.
Afinitas elektron itu menurun ke bawah kelompok serta dari kanan ke kiri melintasi periode pada tabel periodik disebabkana elektron ditempatkan di tingkat energi yang lebih tinggi jauh dari inti, sehingga penurunan dari tarik-nya. Tetapi, orang mungkin berpikir bahwa karena jumlah elektron valensi itu meningkatkan turun golongan, elemen harus lebih stabil serta memiliki tinggi afinitas elektron. Salah satu gagal untuk menjelaskan perisai mempengaruhi. Sebagai salah satu turun periode, efek perisai meningkat, sehingga tolakan itu terjadi antara elektron. Hal itulah sebabnya mengapa daya tarik antara elektron serta inti berkurang ialaha sebagai salah satu turun kelompok dalam tabel periodik.
Sekian dan terima kasih sudah membaca mengenai Pengertian Afinitas Elektron, Sifat, Jenis Dan Polanya, semoga dapat bermanfaat untuk anda.
